27.11.2018
Folge 14: Negative Folgen der Medical Device Regulation auf den Standort Deutschland vermeiden
Ziel der europäischen Medizinprodukteverordnung (Medical Device Regulation – MDR) ist es, das reibungslose Funktionieren des Binnenmarkts von Medizinprodukten zu gewährleisten sowie den Schutz von Patienten und Anwendern in Europa sicherzustellen. Innerhalb der MDR sind deshalb zahlreiche Anforderungen an die Hersteller, Benannten Stellen und Akteure im Gesundheitswesen formuliert, um so Sicherheit und Qualität von Medizinprodukten sicherzustellen. Gleichzeitig soll die klein- und mittelständische Struktur der Branche Berücksichtigung finden. Die MDR wird am 26. Mai 2020 – nach einer Übergangsfrist von drei Jahren – die heute geltende Medizinprodukte-Richtlinie (MDD) und das deutsche Medizinproduktegesetz (MPG) ablösen. Im Vergleich zu anderen Regularien ist diese Frist recht kurz bemessen und erhöht damit den Druck auf die Hersteller.
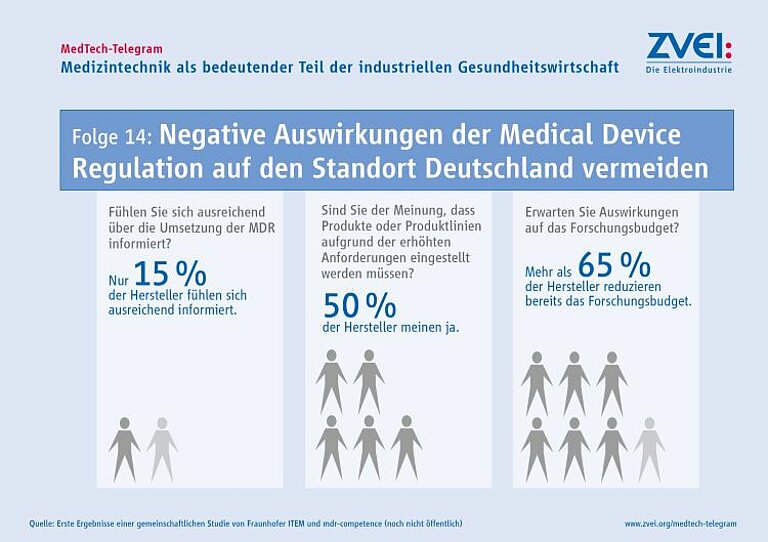
Eine zusätzliche Herausforderung ist, dass wichtige Rechtsakte zur Umsetzung der MDR immer noch nicht vorliegen. Bis jetzt ist außerdem keine einzige der unabhängigen „Benannten Stellen“, die für den Marktzugang der Produkte eine entscheidende Rolle spielen, akkreditiert.“ Ohne Zugang zu einer „Benannten Stelle“ droht die Gefahr, dass Unternehmen im Mai 2020 den Vertrieb von Medizinprodukten in der EU einstellen müssen. Gerade kleine und mittelständische Unternehmen sind dann in ihrer wirtschaftlichen Existenz bedroht – und diese Unternehmen machen über 90 Prozent der Betriebe in Deutschland aus. Auch Innovationen in der Medizintechnik sind durch reduzierte Forschungsbudgets in Gefahr. Insbesondere vor dem Hintergrund einer alternden Bevölkerung, Zunahme von Multimorbidität und fehlenden Fach-/Nachwuchskräfte ist dies besonders beachtenswert. In der Zukunft werden zunehmend individualisierte Therapien notwendig sein und die Medizintechnik leistet hierfür einen wesentlichen Beitrag.