Folge 38: Zu wenig Benannte Stellen für MDR: Innovation in der medizinischen Versorgung gefährdet
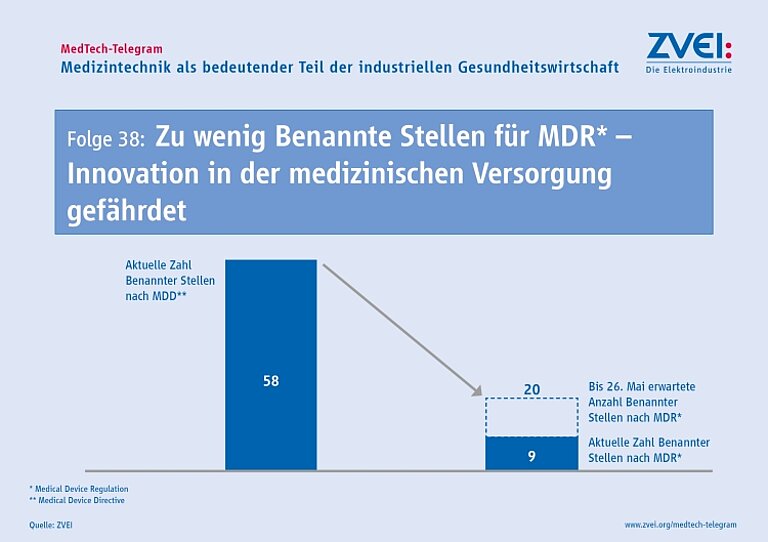
Die geringe Zahl der Benannten Stellen für die Medical Device Regulation wird immer mehr zu einem Problem für die Qualität der medizinischen Versorgung. Denn neu entwickelte Produkte und wesentlich weiterentwickelte Bestandsprodukte können erst dann auf den europäischen Markt gebracht werden, wenn eine Konformitätsbewertung nach MDR erfolgt ist. Dafür ist die Beteiligung einer Benannten Stelle notwendig. Während es unter der bisherigen Medizinprodukte-Richtlinie (MDD) über 50 Benannte Stellen in der EU gab, sind für die MDR aktuell nur neun Benannte Stellen offiziell notifiziert. Die Europäische Kommission erwartet, dass bis zum Geltungsbeginn der MDR am 26. Mai 2020 etwa 20 Benannte Stellen für die MDR notifiziert sein werden.
Damit ist absehbar, dass eine große Zahl von Herstellern zum Geltungsbeginn der MDR nicht in der Lage sein werden, neu entwickelte, innovative Produkte auf den europäischen Markt zu bringen. Für das einzelne Unternehmen ist auch nicht sicher vorhersehbar, wann für sie eine Benannte Stelle zur Verfügung stehen wird. Zusätzlich ist zu berücksichtigen, dass die Auditierung durch die Benannte Stelle und die Verfahren zur Konformitätsbewertung für ein Unternehmen sechs bis zwölf Monate in Anspruch nehmen können.
Die Markteinführung eines fertig entwickelten, innovativen Produktes kann sich damit bis weit in das Jahr 2021 verschieben. Neu entwickelte oder wesentlich verbesserte Produkte stehen damit für die medizinische Versorgung nicht zur Verfügung.
