Folge 57: Corona-Pandemie: „Remote Audit“ für MDR ermöglichen, Versorgung sichern
Anfang April haben die Mitliedstaaten der EU mit einer gemeinsamen Entscheidung den Geltungsbeginn der MDR, der neuen EU-Verordnung über Medizinprodukte, um ein Jahr auf Mai 2021 verschoben. Diese Entscheidung war im Zuge der Corona-Krise sinnvoll, um wichtige Medizinprodukte in der EU verfügbar zu halten.
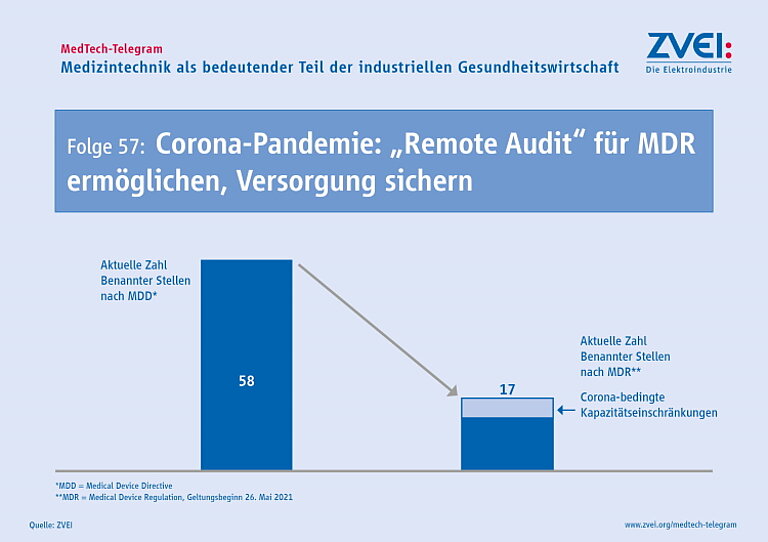
Mit dem Geltungsbeginn der MDR müssen alle Medizinprodukte, die in der EU in Verkehr gebracht werden, einer neuen Konformitätsbewertung nach der MDR unterzogen werden. Dafür ist in vielen Fällen die Beteiligung einer unabhängigen „Benannten Stelle“ notwendig. Bisher standen 58 dieser Benannten Stellen für die Medizinprodukte-Richtlinie der EU (MDD) zur Verfügung. Für die MDR sind Stand Dezember 2020 allerdings nur 17 „Benannte Stellen“ notifiziert worden. Selbst durch die Verschiebung des Geltungsbeginns der MDR auf Mai 2021 ist es bei dieser im Vergleich immer noch geringen Anzahl weiterhin unwahrscheinlich, dass alle notwendigen Audits für die neuen Konformitätsbewertungen bis zum Stichtag durchgeführt werden können. Hinzu kommen die Pandemie-bedingten Reisebeschränkungen: Die notwendigen Audits durchzuführen, die mit einer persönlichen Überprüfung bei den Herstellern einhergehen, wird dadurch zusätzlich deutlich erschwert.
In dieser Situation braucht es eine pragmatische Lösung: Die Europäische Kommission und die EU-Mitgliedstaaten schaffen die Möglichkeit für Prüfer und Hersteller, alle notwendigen Audits auch als „remote audits“, also ohne die persönliche Anwesenheit vor Ort, durchführen zu können. Sogenannte „Erst-Audits“ müssen eingeschlossen sein. Die persönlichen Kontrollen vor Ort sollten zu einem späteren Zeitpunkt nachgeholt werden müssen.
Mit „remote audits“ können mehr neue Medizinprodukte nach den Anforderungen der MDR trotz Reisebeschränkung und geringerer Kapazität von Benannten Stellen in Verkehr gebracht werden. Die Versorgung mit diesen Medizinprodukten kann so besser im kommenden Jahr gewährleistet werden – ohne, dass der Geltungsbeginn erneut verschoben werden muss.
Mehr Infos dazu gibt's auch in den MedTech-Telegrams 41 und 45. Mehr zu den Hintergründen in den Ausgaben 22, 36, 37, 38.
