Folge 58: Erprobung von Innovationen – Weg zur breiten Anwendung immer noch zu lang
Damit eine medizinische Methode – sei es aus Diagnostik oder Therapie – ins Erstattungssystem der Gesetzlichen Krankenkassen (GKV) aufgenommen wird, muss vorher ein Nutzennachweis erbracht werden. Erst dann werden die Kosten von der GKV getragen.
Für die Medizintechnik gibt es dazu Hilfestellung von Politik und Selbstverwaltung: Der Gemeinsame Bundesausschuss (G-BA) kann über eine Erprobungsrichtlinie nach § 137 e SGB V die notwendige wissenschaftliche Studiendurchführung ermöglichen. Aktuelles Beispiel ist die europäische Ausschreibung zur „Amyloid-PET“, einer wegweisenden Methode zur Alzheimer-Diagnostik. Evidenzbasierte Medizin und nachhaltige Finanzierbarkeit sind die richtigen Prinzipien, auf denen das Sozialgesetzbuch V (SGB V) die Vorgaben für den Leistungskatalog der GKV formuliert. Im Sinne guter Patientenversorgung ist wissenschaftlich gesicherte Evidenz unbedingt notwendig.
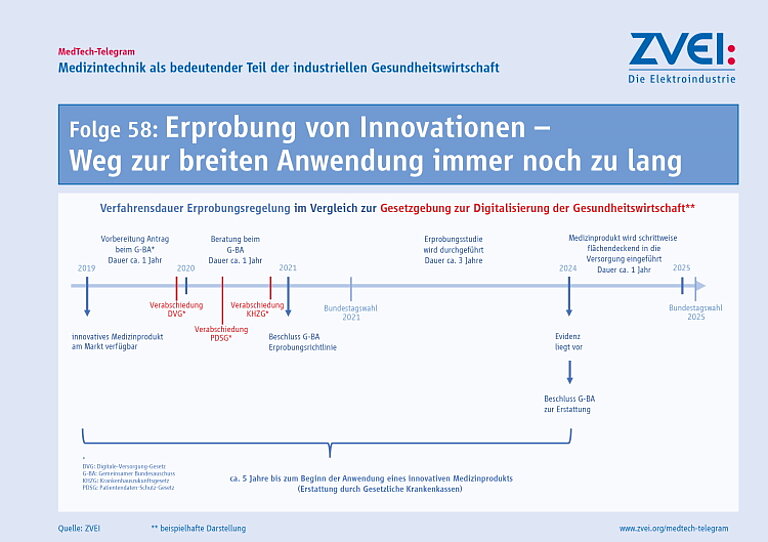
Allerdings erfordert der Nutzennachweis ein umfassendes medizinisch-wissenschaftliches Know-How und einen enormen Zeitaufwand. Für eine Erzeugung dieser Evidenz fehlt für die Medizintechnikindustrie ein praktikables Instrumentarium. Die Organisation und der Aufwand zur Erfüllung der Anforderungen sind nicht für jede mögliche Verwendung von Medizintechnologien separat zu leisten. Bei einer Erprobung nach §137e SGB V dauert es bis zu fünf Jahren von der Beratung, über den Beschluss bis hin zur vollständigen Durchführung einer Studie. Eine schnelle, flächendeckende Anwendung neuer Technologien bei Patienten wird damit stark verzögert.
Das liegt auch daran, dass aktuell nur Evidenz zum rein medizinischen Nutzen akzeptiert wird. Andere Verbesserungen in der Gesundheitsversorgung spielen keine Rolle bei der Bewertung. Eine neue Methode zur Diagnostik, die schneller zu einer wirksamen Therapie führt, wird an den gleichen Kriterien gemessen wie eine völlig neue Methode zur Therapie dieser Erkrankung.
Für medizintechnische Innovationen muss deshalb ein Weg gefunden werden, der einerseits die Patientenversorgung optimal sichert und andererseits den Herstellern ein praktikableres Instrumentarium an die Hand gibt, um die geforderte Evidenz für die Erstattung zu erzeugen. Die Qualität und Wirksamkeit von Medizinprodukten sind durch die Anforderungen der CE-Kennzeichnung stets gewährleistet. In diesem Sinne trägt die neue Verfahrensordnung des G-BA zwar schon dazu bei, das Potenzial innovativer Medizinprodukte besser auszuschöpfen. Insgesamt dauert es aber noch zu lange, bis innovative Medizintechnik flächendeckend in der Versorgung genutzt werden kann.
