17.01.2023
Folge 86: Anpassung der MDR – schnelle Umsetzung und weitere Schritte notwendig
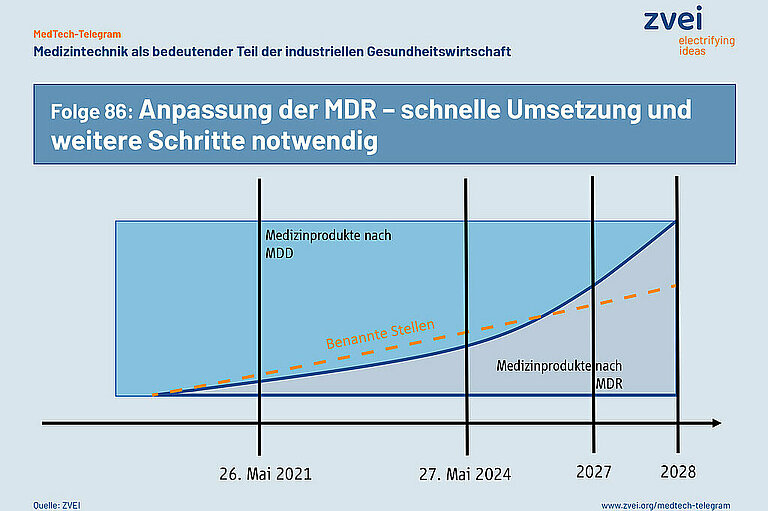
Am 6. Januar 2023 hat die Europäische Kommission Vorschläge zur Anpassung der EU-Verordnung für Medizinprodukte (MDR) vorgelegt. Mit der Anpassung soll verhindert werden, dass Medizinprodukte ab dem 27. Mai 2024 aus bürokratischen Gründen nicht mehr für die Gesundheitsversorgung verfügbar sind. An diesem Termin endet die letzte Übergangsfrist zur Anwendung der MDR. Mediziner weisen bereits seit langem auf diese Gefahr hin.
Die MDR fordert, das alle Medizinprodukte ein neues Konformitätsbewertungsverfahren auf Basis der MDR durchlaufen müssen. Das gilt auch für Bestandsprodukte, die bereits seit langem am Markt sind. Diese Bestandsprodukte tragen eine CE-Kennzeichnung nach der bisher gültigen EU-Richtlinie für Medizinprodukte (MDD). Die Benannten Stellen haben allerdings nicht genügend Kapazität, um alle Bestandsprodukte einer neuen Konformitätsbewertung nach der MDR zu unterziehen.
Die Europäische Kommission schlägt deshalb vor, den Zeitraum, bis zu dem Bestandsprodukte die neue Konformitätsbewertung durchlaufen müssen, bis zum Jahr 2027 und 2028 zu verlängern. Voraussetzung ist, dass die Hersteller bis September 2024 eine schriftliche Vereinbarung mit einer Benannten Stelle getroffen haben. Außerdem sollen bereits produzierte Medizinprodukte mit einer CE-Kennzeichnung auf Basis der MDD ohne zeitliche Begrenzung in den Mitgliedstaaten der Europäischen Union in Verkehr gebracht werden können.
Der Vorschlag der Europäischen Kommission zur Anpassung der MDR kann verhindern, dass Medizinprodukte im Mai 2024 aus bürokratischen Gründen nicht mehr für die Gesundheitsversorgung zur Verfügung stehen. Das Europäische Parlament und die Mitgliedstaaten sollten den Vorschlag deshalb schnell verabschieden. Ebenso schnell müssen aber wichtige Details zur praktischen Anwendung der neuen Regelungen geklärt werden. Nur so kann diese Anpassung der MDR Engpässe bei der Versorgung mit Medizinprodukten in Europa verhindern.
